drs. Roy Keeris
Wetenschapsjournalist
Voorbeeldpublicatie
Statusverhaal - Chemisch2Weekblad, 31 januari 2004,
nummer 2
(c) Roy Keeris
Tissue engineering
Botten ontwerpen

De onderzoeksgroep Orthobiologie van Isotis maakt sinds december deel uit
van het Biomedical Technology Institute van de Universiteit Twente. De
onderzoeksgroep zal het onderzoek naar nieuw bot en kraakbeen voortzetten om
implantaten te ontwikkelen die geheel integreren in het weefsel van de mens.
Isotis werkte al heel lang aan het ontwikkelen van nieuw bot en kraakbeen.
Het bedrijf, in 1996 opgericht door de hoogleraren Clemens van Blitterswijk en
Klaas de Groot kon hiermee op de korte termijn echter geen geld verdienen. Ze
besloten daarom het onderzoek voort te zetten binnen de onderzoeksgroep
Orthobiologie, onlangs overgegaan naar Universiteit Twente. In de orthobiologie
stimuleren onderzoekers herstel en regeneratie van het spier-skeletstelsel door
biotechnologie, materiaalwetenschap en weefselbiologie te combineren. Isotis
richt zich nu op de verkoop van materialen voor weefselherstel.
Van Blitterswijk en De Groot werkten in 1992 al aan botvervangers op het LUMC
in Leiden. Tijdens het kweken van de cellen, ontdekten ze de belangrijke rol van
de extracellulaire botmatrix, een mengsel van stoffen tussen de cellen die het
weefsel de juiste eigenschappen geeft. Dit vormde de basis van hun patenten.
“Ons concept van het kweken wordt inmiddels in veel groepen gebruikt”, zegt Van
Blitterswijk. “We nemen voorlopercellen van bot uit het beenmerg van de patiënt
die we aanzienlijk vermenigvuldigen. Vervolgens brengen we deze op een drager en
implanteren die in een patiënt. We gebruiken calciumfosfaten als
dragermateriaal, want deze lijken veel op de stoffen die in onze eigen botten
zitten. Daardoor vergroeit de drager goed met het oppervlak van echt bot.
Calciumfosfaten zijn bovendien stijver dan bijvoorbeeld polymeren en kunnen
daardoor meer belasting verdragen.”
Momenteel kan een chirurg een gezond stuk bot op een andere plaats in het
lichaam van de patiënt gebruiken. “Je kunt bijvoorbeeld een stuk bekken nemen en
dat inbouwen in de kaak”, licht Van Blitterswijk toe. “Je houdt zo wel twee
operatiegebieden over in plaats van één, en het stuk bekken komt niet terug.”
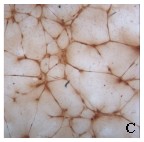 Isotis experimenteerde
lange tijd met het kweken van bot in spierweefsel. Want zou je het in bot doen
dan weet je uiteindelijk niet of de groei te wijten is aan natuurlijk herstel
van het bot of aan het implantaat. De groep stond echter voor een verassing. In
spier bleek zich namelijk meer bot te vormen dan in botweefsel. “We weten de
reden nog niet precies, maar waarschijnlijk komt het omdat spieren rijker zijn
aan bloedvaten”, verklaart Van Blitterswijk. “In bot zit er niks rondom een gat.
Ook spelen stamcellen misschien een rol. Ook deze zijn meer in spieren te vinden
dan in bot, met name in de buurt van kleine bloedvaten.”
Isotis experimenteerde
lange tijd met het kweken van bot in spierweefsel. Want zou je het in bot doen
dan weet je uiteindelijk niet of de groei te wijten is aan natuurlijk herstel
van het bot of aan het implantaat. De groep stond echter voor een verassing. In
spier bleek zich namelijk meer bot te vormen dan in botweefsel. “We weten de
reden nog niet precies, maar waarschijnlijk komt het omdat spieren rijker zijn
aan bloedvaten”, verklaart Van Blitterswijk. “In bot zit er niks rondom een gat.
Ook spelen stamcellen misschien een rol. Ook deze zijn meer in spieren te vinden
dan in bot, met name in de buurt van kleine bloedvaten.”
Angiogenese
De afwezigheid van deze bloedvaten in het gekweekte bot beperkt de grootte
van de botimplantaten overigens tot een halve millimeter. Bij grotere weefsels
lopen de wetenschappers tegen een grens aan. De cellen diep in het weefsel
krijgen dan te weinig voedingsstoffen en zuurstof door het ontbreken van
haarvaatjes. “We gebruiken daarom kleine brokjes materiaal om een groter stuk
implantaat te maken”, legt Van Blitterswijk uit. “Dat is bovendien handiger voor
de chirurg, want die werkt bij een transplantatie ook met een gemalen stuk bot.
Hij hoeft zijn operatietechniek dus niet aan te passen. En als je het materiaal
uiteindelijk uit de bioreactor haalt dan is het alsnog een blok geworden, omdat
de cellen een matrix hebben gemaakt die ze onderling verbindt.”
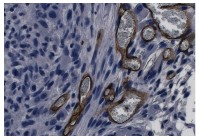 Eenmaal in de patiënt
zullen er toch haarvaatjes in het implantaat moeten groeien om de cellen van
stoffen te voorzien. De ontwikkeling van de bloedvaatjes, een proces genaamd
angiogenese, is in de medische wereld vooralsnog een groot mysterie. De
othobiologiegroep werkt daarom nauw samen met de vakgroep van tissue
engineering-goeroe Robert Langer van het Massachusetts Institute of Technology
(MIT). Isotis-medewerker Jeroen Rouwkema kweekte bij het MIT menselijke
endotheelcellen - cellen die aan de binnenkant van bloedvaten zitten – mee in
spiercelweefsel van een muis. In het spierweefsel bleken zich haarvaatjes te
vormen die zich bovendien gingen verbinden met het vaatnetwerk van de muis. “Dat
is het leuke van bloedvaten”, aldus Van Blitterswijk. “Het lichaam helpt gewoon
mee. We weten nog niet of het verschijnsel door stamcellen wordt veroorzaakt,
maar op een of andere manier vinden de vaatjes elkaar. Veel dingen zullen we
niet eens hoeven te begrijpen om ze toe te passen.”
Eenmaal in de patiënt
zullen er toch haarvaatjes in het implantaat moeten groeien om de cellen van
stoffen te voorzien. De ontwikkeling van de bloedvaatjes, een proces genaamd
angiogenese, is in de medische wereld vooralsnog een groot mysterie. De
othobiologiegroep werkt daarom nauw samen met de vakgroep van tissue
engineering-goeroe Robert Langer van het Massachusetts Institute of Technology
(MIT). Isotis-medewerker Jeroen Rouwkema kweekte bij het MIT menselijke
endotheelcellen - cellen die aan de binnenkant van bloedvaten zitten – mee in
spiercelweefsel van een muis. In het spierweefsel bleken zich haarvaatjes te
vormen die zich bovendien gingen verbinden met het vaatnetwerk van de muis. “Dat
is het leuke van bloedvaten”, aldus Van Blitterswijk. “Het lichaam helpt gewoon
mee. We weten nog niet of het verschijnsel door stamcellen wordt veroorzaakt,
maar op een of andere manier vinden de vaatjes elkaar. Veel dingen zullen we
niet eens hoeven te begrijpen om ze toe te passen.”
‘In spier blijkt zich meer bot te vormen dan in
botweefsel’
Rouwkema probeert deze techniek momenteel te ontwikkelen voor botengineering.
Hij kijkt of hij beenmergcellen ook kan gebruiken om haarvaten te maken. “Op het
lab kunnen we uit beenmerg al vier type weefsel maken: bot, kraakbeen,
bloedvaten en vetweefsel”, zegt Van Blitterswijk. “Dit zijn bouwstenen die je
kunt je combineren om een orgaan te maken, net als dat je bij het bouwen van een
huis ook allerlei onderdelen combineert, zoals verschillende soorten leidingen.”
Ontwerp
De belangrijkste functie van botten is het geven van stevigheid aan het
lichaam. De drager in het botimplantaat moet daarom ook een hoge belasting
kunnen verdragen. Tegelijkertijd moet het veel poriën bevatten zodat de cellen
zich er goed in kunnen verspreiden. “We maken het materiaal daarom behoorlijk
poreus, maar proberen het ook stevig te maken door een aantal massieve plaatjes
in te bouwen die in de richting staan van de belasting. In de kunststofindustrie
wordt dit ook gebuikt bij het spuitgieten. Je gebruikt dan weinig materiaal,
maar het uiteindelijke product is toch stevig.”

Voor onderzoek naar kraakbeenimplantaten ontwerpt Van Blitterswijks groep
dragers op een computer. Een zogenaamde ‘bioplotter’ print vervolgens de
kunststof drager. Een computergestuurde injectienaald drukt langzaam een
gesmolten polymeer naar buiten terwijl het in drie richtingen beweegt. Momenteel
gebruiken de meeste tissue engineers zoutkristallen bij het maken van kunststof
dragers die uiteindelijk de grootte van de poriën bepalen. “Het probleem hierbij
is dat je niet echt kunt ontwerpen”, legt Van Blitterswijk uit. “Het is erg
belangrijk dat de poriën op elkaar aansluiten, anders krijg je dooie ruimte en
daar heb je niets aan. Het is zelfs gevaarlijk. Bacteriën zouden in afgesloten
holtes kunnen groeien en het systeem kan hier niet meer bij.”
Automatisch
Tissue Engineering is in principe nog verder te automatiseren. Diagnose van
de patiënt, het kweken van de cellen en het implanteren kan ook overgelaten
worden aan computers en robots. “Een Amerikaan waar ik een keer een lezing mee
hield gelooft echt dat je straks het ziekenhuis in wordt gereden en door een
scanner wordt gehaald. Vervolgens maakt een printer een matrix en worden er
cellen gezuiverd uit de patiënt. Een robot zou de prothese dan ook nog
implanteren. Ik geloof wel dat het mogelijk is, maar het blijft allemaal erg
dure technologie. Ik geloof meer in een mengvorm van oude en nieuwe techniek.
Bovendien moet je met een nieuwe techniek wel aan een behoefte voorzien,
anders heeft het geen zin. Sommige dingen werken gewoon. En een chirurg
bijvoorbeeld vindt het vaak leuk om een mes te gebruiken. Ooit heb ik met iemand
een kunsttrommelvlies ontwikkeld. Artsen kunnen echter ook een dun plakje
kraakbeen uit de oorschelp gebruiken als vervanging. Wij dachten dat het
handiger zou zijn als je een trommelvlies uit een doosje ‘van de plank’ kunt
pakken, maar artsen vonden het snijden van een plakje veel leuker.”
 Isotis experimenteerde
lange tijd met het kweken van bot in spierweefsel. Want zou je het in bot doen
dan weet je uiteindelijk niet of de groei te wijten is aan natuurlijk herstel
van het bot of aan het implantaat. De groep stond echter voor een verassing. In
spier bleek zich namelijk meer bot te vormen dan in botweefsel. “We weten de
reden nog niet precies, maar waarschijnlijk komt het omdat spieren rijker zijn
aan bloedvaten”, verklaart Van Blitterswijk. “In bot zit er niks rondom een gat.
Ook spelen stamcellen misschien een rol. Ook deze zijn meer in spieren te vinden
dan in bot, met name in de buurt van kleine bloedvaten.”
Isotis experimenteerde
lange tijd met het kweken van bot in spierweefsel. Want zou je het in bot doen
dan weet je uiteindelijk niet of de groei te wijten is aan natuurlijk herstel
van het bot of aan het implantaat. De groep stond echter voor een verassing. In
spier bleek zich namelijk meer bot te vormen dan in botweefsel. “We weten de
reden nog niet precies, maar waarschijnlijk komt het omdat spieren rijker zijn
aan bloedvaten”, verklaart Van Blitterswijk. “In bot zit er niks rondom een gat.
Ook spelen stamcellen misschien een rol. Ook deze zijn meer in spieren te vinden
dan in bot, met name in de buurt van kleine bloedvaten.” 
 Eenmaal in de patiënt
zullen er toch haarvaatjes in het implantaat moeten groeien om de cellen van
stoffen te voorzien. De ontwikkeling van de bloedvaatjes, een proces genaamd
angiogenese, is in de medische wereld vooralsnog een groot mysterie. De
othobiologiegroep werkt daarom nauw samen met de vakgroep van tissue
engineering-goeroe Robert Langer van het Massachusetts Institute of Technology
(MIT). Isotis-medewerker Jeroen Rouwkema kweekte bij het MIT menselijke
endotheelcellen - cellen die aan de binnenkant van bloedvaten zitten – mee in
spiercelweefsel van een muis. In het spierweefsel bleken zich haarvaatjes te
vormen die zich bovendien gingen verbinden met het vaatnetwerk van de muis. “Dat
is het leuke van bloedvaten”, aldus Van Blitterswijk. “Het lichaam helpt gewoon
mee. We weten nog niet of het verschijnsel door stamcellen wordt veroorzaakt,
maar op een of andere manier vinden de vaatjes elkaar. Veel dingen zullen we
niet eens hoeven te begrijpen om ze toe te passen.”
Eenmaal in de patiënt
zullen er toch haarvaatjes in het implantaat moeten groeien om de cellen van
stoffen te voorzien. De ontwikkeling van de bloedvaatjes, een proces genaamd
angiogenese, is in de medische wereld vooralsnog een groot mysterie. De
othobiologiegroep werkt daarom nauw samen met de vakgroep van tissue
engineering-goeroe Robert Langer van het Massachusetts Institute of Technology
(MIT). Isotis-medewerker Jeroen Rouwkema kweekte bij het MIT menselijke
endotheelcellen - cellen die aan de binnenkant van bloedvaten zitten – mee in
spiercelweefsel van een muis. In het spierweefsel bleken zich haarvaatjes te
vormen die zich bovendien gingen verbinden met het vaatnetwerk van de muis. “Dat
is het leuke van bloedvaten”, aldus Van Blitterswijk. “Het lichaam helpt gewoon
mee. We weten nog niet of het verschijnsel door stamcellen wordt veroorzaakt,
maar op een of andere manier vinden de vaatjes elkaar. Veel dingen zullen we
niet eens hoeven te begrijpen om ze toe te passen.” 