Achtergrond
Herstel met eigen weefsel
Tissue engineering/Bauke Vermaas
In het vakgebied van tissue engineering zijn techniek en geneeskunde innig met elkaar verweven. Nieuwe technologieën bieden pasklare reserveonderdelen voor een beschadigd of versleten lichaam, gekweekt in het laboratorium met eigen cellen van de patiënt. Toch zijn nog maar weinig toepassingen van tissue engineering het niveau van het laboratorium ontstegen. Het samenwerkingsproject Translational Regenerative Medicin-programma (TeRM) moet daar verandering in brengen. Dit consortium van technische universiteiten, academische ziekenhuizen en spin-off bedrijven kreeg onlangs vijftien miljoen euro toegekend uit de Smart-Mix-subsidiepot.

Een bioreactor waarin lichaamseigen hartkleppen worden gekweekt. Foto: Bart van Overbeeke
“We willen binnen vijf jaar verschillende technologieën
klinisch toepasbaar maken”, zegt de Twentse hoogleraar Clemens van
Blitterswijk. Hij is kartrekker van het Translational Regenerative
Medicinprogramma (TeRM), waarin onderzoekers van de UT en de TU/e
samenwerken met verschillende academische ziekenhuizen en vijf spin-off
bedrijven. Het programma heeft als doel tissue engineering-technieken
toepasbaar te maken in het ziekenhuis. “We concentreren ons op twee
groepen weefsels. De ene helft van de projecten richt zich op het herstel
van bot en kraakbeen en de andere helft op weefselherstel in hart en
bloedvaten.”
In totaal worden binnen TeRM acht projecten gestart die de
komende vijf jaar de technologie naar de kliniek moeten brengen. Hoewel
het gaat om hersteltechnieken voor zeer verschillende weefsels, hebben de
projecten elkaar nodig om succesvol te zijn. “Kennis van bioreactoren en
stamcellen is in alle projecten belangrijk en ook met regelgeving krijgen
alle projecten te maken”, zegt Van Blitterswijk. “De kracht van TeRM is
dat de opgedane kennis voor alle partners beschikbaar is, zodat het doel
om de technologie in korte tijd naar de kliniek te brengen, ook haalbaar
wordt.”
Volgens Van Blitterswijk is ook de deelname van spin-off
ondernemingen aan het consortium onontbeerlijk. “Als we in het
laboratorium een nieuwe technologie ontwikkelen, zoeken we naar het bewijs
dat de technologie werkt. Maar dan heb je nog geen bruikbaar product. De
echte productontwikkeling moet in een bedrijf gebeuren, dat is geen taak
voor de universiteit.”
Veelbelovende technologieën, bundeling en
uitwisseling van kennis, samenwerking tussen onderzoekers, artsen en
bedrijven: het kan haast niet anders of binnen vijf jaar zijn via
tissue-engineering ontwikkelde hartkleppen, bloedvaten, heupen en knieën
gemeengoed. Van Blitterswijk is dan ook zeker optimistisch, al heeft hij
geleerd van het verleden. “Het TeRM-programma is ook nodig om uit te
zoeken wat al die veelbelovende technologieën echt waard zijn voor artsen
en patiënten”, zegt hij. “Helaas zijn goede resultaten in kweekschalen of
zelfs proefdierexperimenten geen garantie dat een methode ook werkt in
mensen. In het verleden hebben we dat gezien met tissue engineering van
bot. We hebben in 1997 IsoTis opgericht om de technologie daarvoor naar de
kliniek te brengen. De resultaten vielen toen erg tegen: bij de patiënten
vonden we veel minder bot dan in de proefdierexperimenten. Kennelijk was
de technologie nog niet rijp. Nu zijn we echter tien jaar verder en denken
we dat de klinische experimenten wel succesvol zullen zijn. Het huidige
dragermateriaal voor de botcellen is bijvoorbeeld tien keer beter dan wat
we destijds gebruikten. Het dragermateriaal fungeert niet meer alleen als
een mal die zorgt dat het nieuwe bot de juiste vorm krijgt, maar zet de
cellen ook actief aan tot het maken van nieuw botweefsel.”
Fitness met hartkleppen
Een baby met een
aangeboren hartafwijking krijgt kort na de geboorte een nieuwe hartklep.
Precies op maat en gemaakt uit cellen die tijdens de zwangerschap uit het
vruchtwater zijn gehaald. Er zijn geen afstotingsproblemen en de klep
groeit mee met het hartje van de patiënt, waardoor vervolgoperaties niet
nodig zijn. Aan de TU/e worden al lichaamseigen hartkleppen gemaakt, die
binnen het TeRM-programma in vijf jaar geschikt worden gemaakt voor
gebruik in patiënten.
In een grote, lichte laboratoriumruimte opent de
Eindhovense hoogleraar Soft Tissue Biomechanics & Engineering Frank
Baaijens een broedstoof met enkele hartkleppen in spe. Ze groeien in
bioreactoren waar een vloeistof doorheen wordt gepompt. Zo wordt het
kweekmedium steeds ververst en went het weefsel aan de drukverschillen in
het hart. “We halen cellen uit de wand van een bloedvat in het been die we
eerst vier weken opkweken, zodat we er genoeg van hebben”, vertelt
Baaijens. “Vervolgens zaaien we ze in een afbreekbare mal. Gedurende nog
eens vier weken degradeert die mal en groeien de cellen uit tot een stukje
weefsel in de vorm van een hartklep. De ‘hartslag’ die we in de bioreactor
simuleren, zorgt ervoor dat het weefsel de benodigde stevigheid krijgt. De
cellen worden als het ware getraind.”
Patiënten met een defecte
hartklep kunnen momenteel op twee manieren geholpen worden. Wie ouder is
dan 65 jaar krijgt meestal een bioprothese, een stukje dood
hartklepweefsel van bijvoorbeeld een varken. Zo’n bioprothese gaat slechts
een jaar of tien mee. Daarom krijgen jongere patiënten vaak een
kunsthartklep. Die blijft in principe goed, maar de patiënt moet
levenslang antistollingsmiddelen gebruiken. Voor jonge patiëntjes is dat
niet het grootste probleem. Baaijens: “Kinderen die in de groei zijn,
moeten vaak meerdere keren geopereerd worden, omdat de kunsthartklep te
klein is geworden. Dat zijn flinke ingrepen, met grote kans op
complicaties. Vandaar dat kinderartsen een hartklep zouden willen van
lichaamseigen materiaal, die met het hart meegroeit.”
In 2000 werd in
Harvard een doorbraak in het onderzoek naar lichaamseigen hartkleppen
bereikt. Onderzoeker Simon Hoerstrup, die momenteel vanuit Zürich nauw
samenwerkt met Baaijens’ groep, wist voor het eerst een lichaamseigen
hartklep bij een schaap te implanteren. “Dat gebeurde aan de lage druk
zijde van het hart”, benadrukt Baaijens. “De kleppen waren nog niet sterk
genoeg om aan de hoge druk zijde goed te functioneren. Wij zijn toen
betrokken bij het onderzoek om de mechanische eigenschappen van de kleppen
te verbeteren. Ook zijn we overgestapt van dierlijk materiaal naar
menselijke cellen.”
In 2005 promoveerde Anita Mol in Eindhoven op
menselijke hartkleppen die in testsystemen sterk genoeg bleken om aan de
hoge druk kant van het hart te worden gebruikt. “Met haar protocol gingen
we vervolgens weer dierlijke hartkleppen produceren. Dat was nog vrij
lastig, omdat het toch wat ander materiaal is. Nu ook de dierlijke
hartkleppen in het laboratorium goed werken, zijn we toe aan dierproeven”,
aldus Baaijens.
Die dierproeven zijn onderdeel van het TeRM-programma.
Als ze succesvol zijn, is de verwachting dat binnen vijf jaar in het
project Heart Valve Tissue Engineering towards Clinical Practice de eerste
patiënten een gekweekte, lichaamseigen hartklep krijgen. Baaijens is ervan
overtuigd dat dit zal lukken, al ziet hij nog wel wat uitdagingen. Van
cruciaal belang is de vraag of de lichaamseigen hartkleppen inderdaad
meegroeien met de patiënt. “Dat is een van de dingen die we uit het
dierproefonderzoek willen leren. Maar we zijn optimistisch. In Zürich is
vorig jaar gebleken dat een met tissue engineering gemaakt bloedvat,
geïmplanteerd in een jong schaap, de anatomische groei van dat schaap
netjes volgt.”
De Eindhovense onderzoeksgroep werkt in dit project niet
alleen samen met Zürich, maar ook met spin-off bedrijf QTIS en het UMC
Utrecht. “Die samenwerkingsverbanden zijn essentieel voor het onderzoek.
QTIS zal zich bezighouden met het ontwikkelen van protocollen en
gecontroleerde laboratoriumomstandigheden en de ziekenhuizen dragen zorg
voor de klinische trials.”

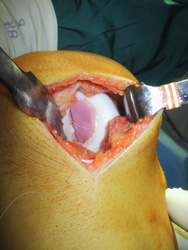
Een gat in het kraakbeen van de knie (foto
links) wordt gedicht met een afbreekbare mal met kraakbeencellen van de
patiënt.
Foto: Bart van Overbeeke
Kraakbeen kweken
Beschadigd kraakbeen heelt niet
of nauwelijks, maar tissue engineering maakt mogelijk wat het lichaam zelf
niet kan. Buiten het lichaam kweken van vervangend kraakbeen is tot nu toe
de enige vorm van regeneratieve geneeskunde die in mensen wordt toegepast.
De techniek is aantoonbaar beter dan de gangbare therapie, maar is duur en
vereist meerdere operaties die een langdurig herstel vergen. Daarom werken
artsen en onderzoekers binnen het TeRM-programma aan een nieuwe
celtherapie, waarvoor maar één operatie nodig is en de revalidatietijd
halveert.
Kraakbeen is de schokdemper van onze gewrichten. Het is een
taai en sterk weefsel dat veel kan hebben, maar áls er schade optreedt,
bijvoorbeeld door een sportblessure, is die meestal blijvend.
Kraakbeenschade treft vaak jonge mensen in de bloei van hun leven. Daniël
Saris, orthopeed in het Universitair Medisch Centrum Utrecht (UMCU),
illustreert dit met een MRI-foto van een geblesseerde knie van een
hockeyspeelster. Zelfs voor een leek is het gat in het kraakbeen te zien.
Het weggeslagen kraakbeen ‘zwerft’ in dit geval nog rond in het
kniegewricht. Tot voor kort kon een patiënt als deze alleen behandeld
worden met een zogenoemde microfractuurbehandeling. “Daarbij maken we
gaatjes in het onderliggende bot, zodat stamcellen uit het binnenste van
het bot het ontbrekende kraakbeen vervangen en uiteindelijk uitgroeien tot
nieuw weefsel”, vertelt Saris. “Die oplossing is verre van ideaal. Vaak
ontstaat er littekenweefsel en blijven patiënten klachten houden. Met
celtherapie is het weefselherstel van hogere kwaliteit.”
Saris heeft
samen met een groep chirurgen uit België, Duitsland en Kroatië de
microfractuurbehandeling in een klinische trial vergeleken met ACI, wat
staat voor Autologous Chrondrocyte Implantation (chondrocyten zijn
kraakbeencellen). Bij deze celtherapie wordt een kleine hoeveelheid
kraakbeencellen van de patiënt afgenomen en in het laboratorium opgekweekt
tot er genoeg zijn om het gat in het kraakbeen te vullen. Dit bleek beter
kraakbeen op te leveren dan de gangbare microfractuurbehandeling. Wel kost
de behandeling veel tijd.
“Kraakbeencellen zijn één van de langzaamste
cellen die we hebben”, vertelt onderzoeker en ondernemer Jens Riesle. “In
het lichaam delen ze zich nauwelijks, vandaar dat kraakbeen zo moeilijk
herstelt. Ook in het laboratorium kost het kweken van kraakbeencellen
minstens enkele weken. Dat maakt ACI een kostbare behandeling.” Riesle is
een van de oprichters van CellCoTec, een spin-off bedrijf van de UT.
CellCoTec ontwikkelt in nauwe samenwerking met de orthopedische afdeling
van het UMCU een celtherapie waarmee kraakbeen kan worden hersteld zonder
dat daar dure en tijdrovende celkweek voor nodig is. De basis voor de
nieuwe therapie werd gevormd door het onderzoek van UT-promovenda Jeanine
Hendriks. “Het revolutionaire van deze therapie is dat we kraakbeencellen
ín het lichaam ertoe aanzetten om het defecte kraakbeen te repareren”,
zegt Riesle. “Er komt geen celkweek aan te pas.” De truc zit hem in het
combineren van celtypen. Gekweekte kraakbeencellen kunnen minder goed
weefsel maken dan verse cellen, maar daarvan hebben de patiënten er te
weinig om in korte tijd een gat in het kraakbeen met nieuw weefsel op te
vullen. Nu blijkt echter dat verse kraakbeencellen gemixt met
beenmergcellen van dezelfde patiënt ook in staat zijn om nieuw weefsel te
maken. Zelfs als het mengsel maar twee procent verse kraakbeencellen
bevat, ontstaat er meer functioneel weefsel dan met gekweekte
kraakbeencellen alleen. Riesle: “In één operatie wordt kraakbeenweefsel en
beenmerg van de patiënt afgenomen. De benodigde cellen worden geïsoleerd,
gemixt en gezaaid op een biologisch afbreekbare mal ter grootte van het
ontbrekende kraakbeen en vervolgens teruggeplaatst in de knie. In de knie
organiseren de cellen zich uiteindelijk tot nieuw, functioneel
kraakbeenweefsel.” De techniek heeft als voordeel dat de patiënt al vrij
snel na de operatie zijn knie weer kan belasten, omdat de mal de functie
van kraakbeen overneemt zolang het nieuwe weefsel nog niet af is. De
belasting zorgt bovendien voor een soort training, waardoor het nieuwe
weefsel sneller de sterkte en elasticiteit van kraakbeen krijgt. In de
komende jaren zal de therapie worden getest bij geiten. Bij goede uitkomst
van de dierstudies verwacht Saris binnen vijf jaar de eerste menselijke
patiënten te kunnen behandelen. “De dierproeven zijn nodig om te bewijzen
dat kraakbeenherstel op deze manier, in het lichaam, mogelijk is. Er
hoeven geen wezenlijke nieuwe chirurgische technieken te worden
ontwikkeld. Wel is er nog veel onderzoek nodig op het gebied van
beeldvormingstechnieken. We willen MRI inzetten om enerzijds de
kraakbeendefecten vroeger op te sporen en anderzijds het herstel van het
weefsel na de ingreep te kunnen volgen”, vertelt Saris. De ontwikkeling
van beeldvormingstechnieken doet Saris samen met collega’s van het UMC
instituut ImagO en het Erasmus Medisch Centrum in Rotterdam. Ook leidt hij
collega’s op om de benodigde operaties te kunnen doen. Ondertussen zal
CellCoTec zich bezighouden met het ontwikkelen van een disposable apparaat
waarin de cellen van een patiënt tijdens een operatie gemixt en gezaaid
worden. Doel is de kosten zo laag te houden dat de investering voor een
ziekenhuis geen drempel vormt om de behandeling aan te bieden. Zowel
Riesle als Saris heeft er vertrouwen in dat deze nieuwe vorm van
celtherapie snel zijn weg naar de patiënt zal vinden. “Dit is echt
onderzoek dat is ingegeven door een klinische vraag en daarom is het ook
gehonoreerd door SmartMix”, zegt Saris. “Met dit project lossen we een
concreet probleem op en brengen we de regeneratieve geneeskunde een stap
vooruit.”/.

De Twentse celbioloog Clemens van Blitterswijk is
kartrekker van TeRM. Foto: Gijs van Ouwekerk.

TU/e-hoogleraar Frank Baaijens. Foto: Bart van
Overbeeke

Jens Riesle van het bedrijf CellCoTec. Foto: Ivar
Pel
Orthopeed Daniël Saris. Foto: Ivar Pel